Cette page fournit des informations pour guider les importateurs de masques chirurgicaux dans l’UE. Nous faisons la distinction entre le masque chirurgical et le masque de protection respiratoire individuelle (de type FFP2). Nous examinons les réglementations et la certification CE concernées afin que vous puissiez faire des choix plus judicieux et plus sûrs lorsque vous choisissez des fournisseurs et des produits chinois.
Quel type de masques importer en Europe ?
Les différentes catégories de masques
L’Europe est aujourd’hui l’une des régions les plus durement touchées par le COVID-19, ce qui entraine une hausse de la demande de masques et de tout autre type d’équipement de protection individuelle (EPI).
En ce qui concerne l’importation en UE de masques destinés à être utilisés pour lutter spécifiquement contre le coronavirus, il existe deux grandes catégories de masques européens qui font l’objet de réglementations différentes :
- Dispositifs médicaux (DM) – masques chirurgicaux destinés à protéger l’environnement contre la contamination par le porteur. -> (MD ou Medical Devices)
Ceux-ci relèvent du champ d’application de la directive sur les dispositifs médicaux (DDM). - Équipement de protection individuelle (EPI) – Le masque de protection respiratoire individuelle (de type FFP2) filtrant destinés à protéger le porteur contre les infections microbiennes et virales. -> (EPI, catégorie III)
Ceux-ci relèvent du champ d’application du règlement EPI.
Il existe d’autres types de masques (masques en tissus ou coton, par exemple), mais ils ne seront pas certifiés CE comme étant adaptés à une utilisation dans un environnement médical ou pour protéger l’utilisateur contre les infections.
Des normes européennes harmonisées
Si vous savez maintenant quelle classification de masque vous souhaitez importer, il est utile de comprendre les normes européennes de santé, de sécurité et de performance auxquelles les produits doivent se conformer.
- Le masque anti-projections (de type « chirurgical »)
EN 14683:2019 pour les masques faciaux de type non-PPE (communément appelés masques, masques médicaux, masques chirurgicaux, etc) qui sont des dispositifs médicaux (MD).
- Le masque de protection respiratoire (de type FFP2)
EN 149:2001+A1:2009 pour les masques EPI de type FFP2 (respirateurs).
DocShipper Alert
Alerte DocShipper : A terme, ils devront tous être munis d’un marquage CE, c’est-à-dire être conformes aux diverses exigences européennes en matière de sécurité et de réglementation. Toutefois, les produits « EPI » ne nécessitent PAS d’évaluation clinique, contrairement aux masques de protection respiratoire.
Masques chirurgicaux classés comme MD en UE
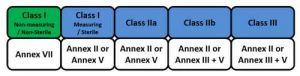
Les masques sont généralement des dispositifs médicaux de classe I, II ou IIR qui sont destinés à protéger le patient ou l’environnement du porteur. Les classes se distinguent par le BFE et le Delta P (où les classes II et IIR ont une efficacité supérieure) et par leur résistance aux éclaboussures (R).
Masque de classe I MD: Conformités les plus faibles autorisées (voir le tableau ci-dessous)
Masque de classe II MD: BFE supérieur à la classe I
Masque facial du médecin de classe IIR: BFE supérieur, Delta P, ET résistant aux éclaboussures
Ils offrent tous une protection limitée contre les gouttelettes, les éclaboussures et, dans une moindre mesure, les aérosols. En effet, seuls les appareils de la classe IIR sont effectivement considérés comme résistants aux éclaboussures.
Tests en laboratoire pour les masques destinés à l’UE
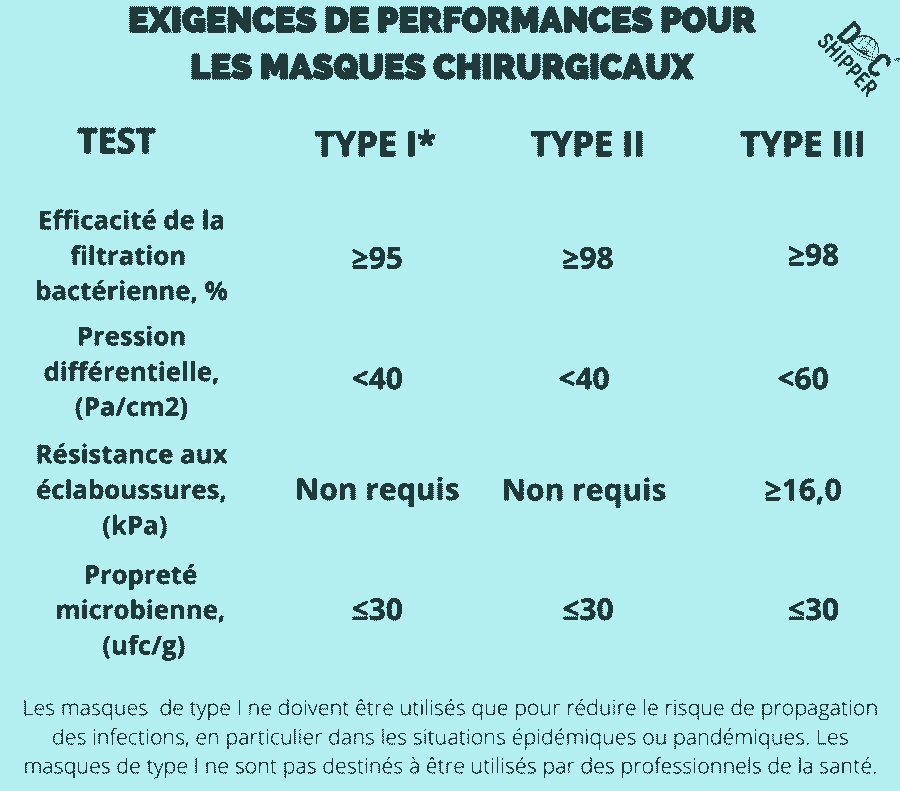
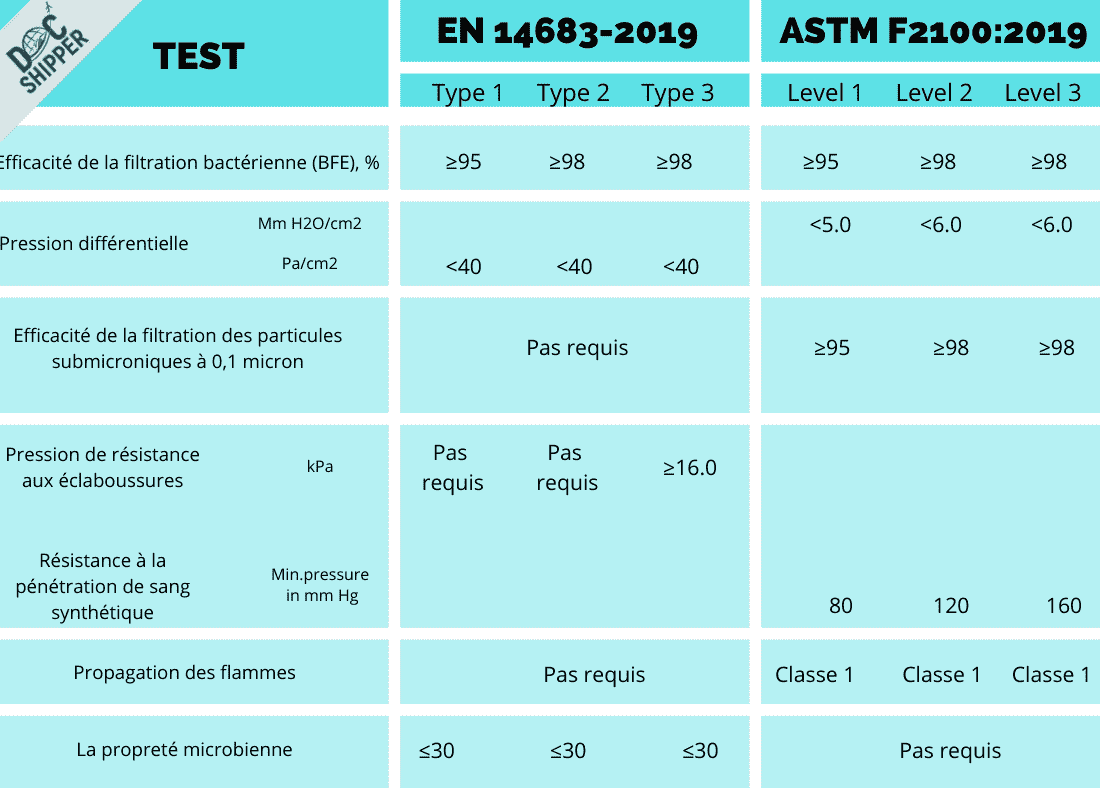
Afin d’être conformes à la norme EN 14683:2019, les masques seront soumis aux essais suivants afin atteindre ces exigences de performance pour les différents types (I, II, IIR) :
Les masques médicaux de type I ne doivent être utilisés que pour les patients et les autres personnes afin de réduire le risque de propagation des infections, en particulier dans les situations épidémiques ou pandémiques. Les masques de type I ne sont pas destinés à être utilisés par des professionnels de la santé.
Efficacité de la filtration bactérienne (BFE), %
Ce test mesure la capacité du masque à filtrer les bactéries en suspension dans l’air.
L’objectif est d’obtenir un taux de réussite ≥95% pour le filtrage des gouttelettes d’aérosols contenant des bactéries qui sont aspirées à travers le masque dans un environnement de laboratoire.
Pression différentielle (Delta P), Pa/cm2
Ce test mesure le débit d’air à travers le masque, ce qui a un effet sur le port et le confort de l’utilisateur. L’objectif est d’obtenir un taux de <40 Pa/cm2.
Propreté microbienne (ISO 11737-1:2018)
Tester la population de microorganismes sur ou dans un produit de santé, un composant, une matière première ou un emballage, le taux visé étant ≤30 cfu/g.
Évaluation biologique
Les masques doivent faire l’objet d’une évaluation biologique conformément à la norme ISO 10993-1:2018. Les masques étant en contact prolongé avec la peau, des tests (ISO 10993-5,2009) de sensibilité cutanée et des essais concernant la cytotoxicité doivent être effectués.
Les résultats des tests de laboratoire seront soumis dans le cadre du TF (dossier technique) qui constitue le processus d’enregistrement du marquage CE.
Le processus de marquage CE pour les masques
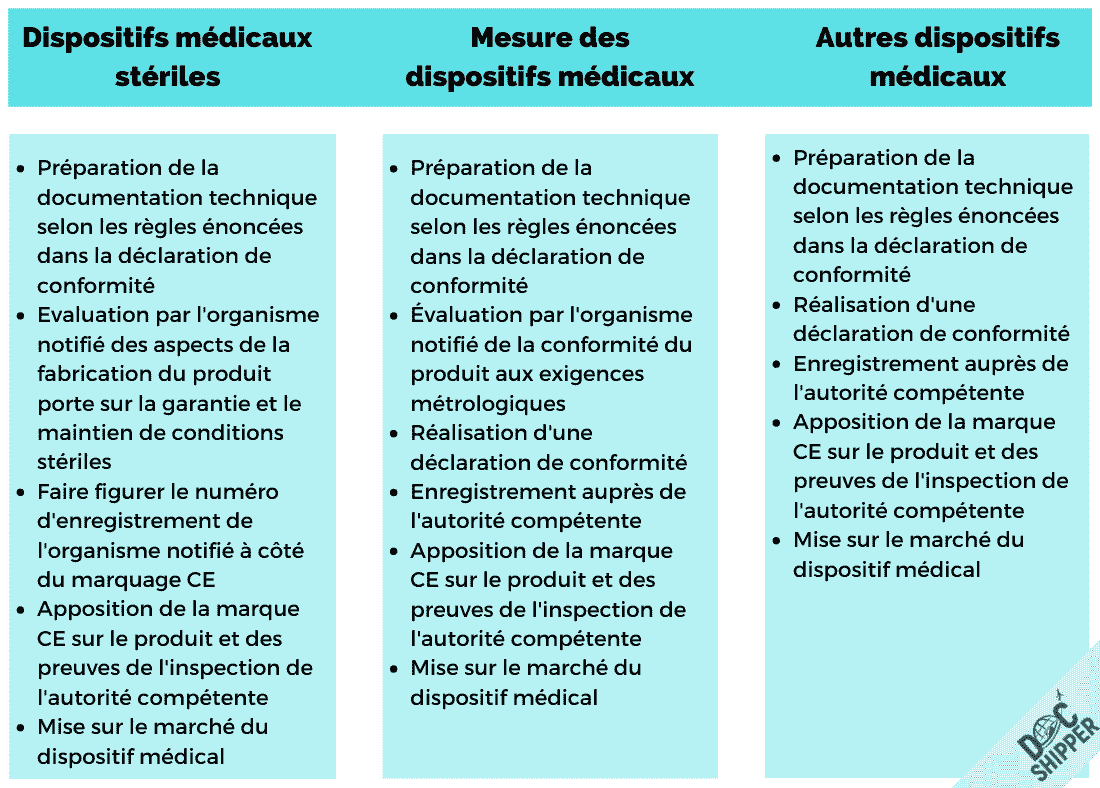
Lors de l’importation de masques en UE, l’obtention du marquage CE est un élément intégral qui permet de les importer et de les vendre en Europe. Le processus comprend :
- Déterminer la classification des dispositifs médicaux (MD): classe I, II, III
- Choisir une procédure d’évaluation de la conformité selon les normes européennes harmonisées (EN 14683:2019)
- Sélectionner l’organisme notifié pour les essais de performance (non requis pour les médicaments de classe I, sauf s’ils sont vendus comme stériles)
- Mettre en œuvre un système de gestion de la qualité (SGQ) – Si le fabricant est certifié ISO 13485 pour les dispositifs médicaux, cela garantira la sécurité et la qualité, mais d’autres formes de SGQ peuvent être acceptables.
- Préparer le dossier technique (TF) ou le dossier de conception – Comprend les dessins de conception, les dossiers d’étiquetage, les dossiers d’emballage, la liste des normes ou directives EN applicables (telles que la norme EN 14683), les rapports d’essais en laboratoire, les rapports d’inspection du contrôle de qualité du produit, l’évaluation des risques
- Nommer un représentant autorisé désigné par la CE (pour les fournisseurs non européens)
- Audit par l’organisme notifié concernant le SGQ et du dossier technique (non requis pour les MD de classe I, sauf s’ils sont vendus comme stériles)
- Enregistrer le dispositif médical – le produit doit être enregistré auprès de l’autorité nationale du pays où il doit être importé et vendu parce qu’il s’agit d’un dispositif médical
- Le fabricant prépare une déclaration de conformité (DoC) – Cette auto déclaration comprend l’UGS, les caractéristiques du produit, le manuel d’utilisation, les coordonnées du fabricant/importateur, la liste des normes ou directives EN applicables (telles que EN 14683), le lieu de fabrication, le nom de la personne responsable.
L’UE fournit un guide complet votre déclaration de conformité CE. - Apposez la marque CE – Celle-ci sera apposée sur le produit et son emballage. Vous pouvez lire les règlements relatifs au marquage CE ici.
Masques de protection stériles
Si les masques sont vendus comme étant stériles, il faudra également obtenir des tests et des audits d’un organisme notifié. En plus d’exiger une production dans un environnement stérile et, éventuellement, l’utilisation de matériaux différents, la documentation sera différente :
- Les informations sur le type de masque comprendront la mention « STÉRILE ».
- Le marquage CE (sur l’article et/ou l’emballage) sera suivi de l’identification à quatre chiffres de l’organisme notifié participant à l’essai de type du produit et à l’audit de la production.
- Le système de management de la qualité du fabricant doit être certifié selon la norme EN ISO 13485.
Étiquetage des masques de protection des médecins
Le produit et l’emballage devront présentés :
- La marque CE
- Norme EN 14683
- Type ; I, II, ou IIR
- Numéro d’article
- Les données d’identification de l’entreprise qui met le produit sur le marché et le signataire de la déclaration CE
- Informations sur la traçabilité et code de lot
- Date limite d’utilisation
Le masque de protection respiratoire (de type FFP) – classés EPI en UE
Dans le langage réglementaire européen, les respirateurs sont connus sous le nom de « masques FFP » (Filtering Facepiece Particles) ou masques de protection respiratoire.
Contrairement aux masques MD de classe I, ces masques bien ajustés sont principalement fabriqués à partir de matériaux filtrants pour protéger le porteur contre les particules et les aérosols nocifs, tels qu’un coronavirus en suspension dans l’air. Habituellement portés dans un environnement médical, ces masques doivent répondre à une norme différente de celle des masques de classe I et ne sont pas du tout classés comme des dispositifs médicaux. En fait, ils sont classés comme des équipements de protection individuelle (EPI) de catégorie III avec une « conception complexe ».
Qu’est-ce que les EPI ?
L’UE définit les EPI (équipement de protection individuelle) comme suit :
Les masques jetables et réutilisables assurant une protection contre les risques liés aux particules, les combinaisons jetables et réutilisables, les gants et les lunettes de protection, qui sont utilisés pour la prévention et la protection contre les agents biologiques nocifs tels que les virus, sont des produits relevant du champ d’application du règlement (UE) 2016/425 et abrogeant la directive 89/686/CEE du Conseil.
Classifier les masques FFP
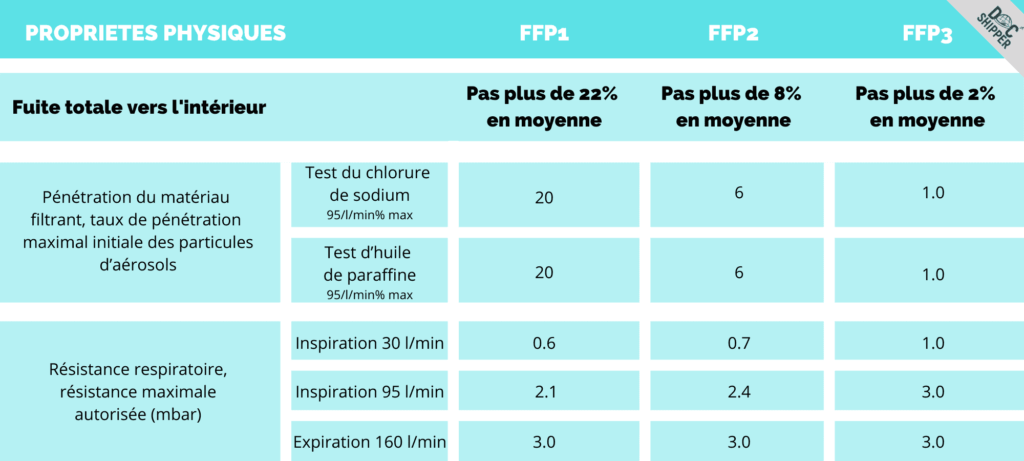
La norme européenne EN 149:2001+A1:2009 définit les classes suivantes de « demi-masques filtrants » qui sont conçus pour protéger contre les solides, les aérosols à base d’eau et les aérosols à base d’huile :
Les masques « N95 » sont peut-être le terme le plus courant pour désigner les PFC. Ce terme provient en fait de la réglementation américaine. Les utilisateurs européens doivent donc savoir que leur équivalent approximatif est le « FFP2 ». En outre, dans un cadre médical, il est probable que seuls les masques FFP2 et FFP3 seront utilisés, car ils filtrent au moins 94 % des particules en suspension dans l’air.
Tests de laboratoire sur les masques FFP pour la certification CE
Pour être conformes à la norme EN 149:2001+A1:2009, les masques FFP sont soumis aux tests suivants
CEN/TC 79/WG 9 – Méthodes d’essai et interprétation des normes CEN/TC 79 :
- Détermination de la fuite vers l’intérieur et de la fuite totale vers l’intérieur
- Tests pratiques de performance
- Tests à la flamme
- Résistance au pétrole
- Respirabilité
- Détermination de la pénétration des filtres à particules
- Détermination de l’encrassement par la poussière
- Test de résistance mécanique
Vous trouverez ci-dessous la liste des exigences de la norme EN149 se référant aux tests ci-dessus et l’exigence de réussite pour les respirateurs FFP :
Le processus de marquage CE pour les « EPI complexes » comme les masques FFP
Après les essais en laboratoire, la procédure à suivre pour obtenir le marquage CE qui permet de les importer et de les vendre en Europe est la suivante (il existe certaines différences entre les EPI et les « dispositifs médicaux » comme les masques faciaux) :
- Déterminer la classification des EPI (catégorie I, II, III)
- Choisir la procédure d’évaluation de la conformité du bon organisme notifié – conforme aux normes européennes harmonisées (EN 149:2001+A1:2009)
- Créer des tests et de la documentation technique
- Faire l’objet d’un examen de type CE par l’organisme notifié
- Créer une déclaration de conformité du fabricant (DoC) – Cette autodéclaration comprend l’UGS, les caractéristiques du produit, le manuel d’utilisation, les coordonnées du fabricant/importateur, la liste des normes ou directives EN applicables (telles que EN 14683), le lieu de fabrication, le nom de la personne responsable.
L’UE fournit un guide complet pour l’établissement de votre déclaration de conformité CE. - Apposez le marquage CE – Il sera apposé sur le produit lui-même et peut se trouver sur l’emballage. Vous pouvez lire les règlements relatifs au marquage CE ici.
- Système de contrôle de la qualité CE du produit final ou système permettant d’assurer la qualité de la production par le biais de la surveillance
Étiquetage pour importer et à vendre dans l’UE
En outre, chaque appareil respiratoire et emballage du FFP doit être étiqueté comme suit
- Nom du fabricant
- Référence du masque
- Numéro CE de l’organisme de certification + EN 149 : 2001 + la classe du masque (FFP1, FFP2 ou FFP3) +l’acronyme (NR – non réutilisable ou R – réutilisable)
- Le marquage doit être conforme à la directive 89/686 / CEE[3] sur les EPI. Si l’une de ces mentions est manquante, le masque sera considéré comme non conforme.
Voici un exemple de la manière dont les PFC européens doivent être étiquetés :
La certification CE pour importer des produits
Dans cette section, nous allons expliquer comment nous vérifions en détail la certification CE pour les masques (classe I MD) et les masques FFP (EPI) qui vont être importés dans l’UE, car ces produits doivent obtenir une marque CE avant de pouvoir être commercialisés et utilisés.
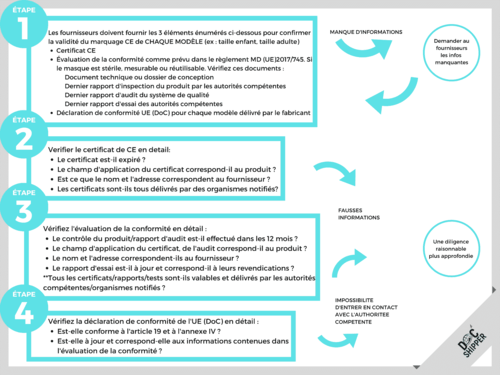
Comment vérifier le certificat CE des dispositifs médicaux (MD), masques de classe 1 ?
Si les dispositifs de classe I, qui sont non stériles, non réutilisables et non mesurables, ne nécessitent pas d’organisme notifié, tous les autres produits nécessitent l’intervention d’un organisme notifié.
Pour plus de détails sur la classification, veuillez lire : « CHAPITRE III RÈGLES DE CLASSIFICATION«
Le « guide de catégorisation » de la Commission européenne sur les EPI 89/686/CEE précisait dans son explication de la catégorie 7.3. que les « masques chirurgicaux » étaient exclus du champ d’application des EPI 89/686/CEE mais ajoutés en note de bas de page (3) :
« Lorsque ces masques sont destinés à protéger le porteur contre les infections microbiennes et virales, etc., ils relèvent de la catégorie de certification III (protection individuelle plutôt qu’usage médical) ».
Les fabricants de dispositifs médicaux de classe I peuvent choisir l’une des trois voies possibles de marquage CE:
La procédure d’évaluation de la conformité pour les dispositifs de classe I devrait être effectuée, en règle générale, sous la seule responsabilité des fabricants, compte tenu du faible niveau de vulnérabilité associé à ces dispositifs.
Pour les dispositifs des classes IIa, IIb et III, la participation d’un organisme notifié est obligatoire.
L’organisme notifié doit auditer le système de gestion de la qualité pour déterminer s’il satisfait les exigences visées. Lorsque le fabricant utilise une norme harmonisée ou une spécification commune (CS) relative à un système de gestion de la qualité, l’organisme notifié évalue alors la conformité à ces normes ou ces CS.
DocShipper Tip
Conseil DocShipper : Effectuez une recherche dans la base de données NANDO pour verifier si votre organisme est notifié pour les MD réglementés (UE) 2017/745. (Les organismes notifiés pour les MD ne sont pas tous compétents pour tous les types de MD, vous devez donc vérifier pour chaque produit).
Comment contacter les organismes notifiés pour confirmer la validité des rapports/tests ?
- Essayez de vérifier le rapport directement via le site web officiel des organismes (voici quelques exemples de sites web d’organismes officiels que vous pourriez souhaiter vérifier : BSI, TUV Rheinland, TUV Sud).
- Si ce n’est pas le cas, envoyez un courriel ou appelez les organismes.
Enfin, pour les masques faciaux (3 couches) uniquement :
EN 14683 est une norme européenne
ASTM F2100 est une norme américaine
Comment vérifier un certificat CE pour des masques FFP ?
Les produits EPI nécessitent toujours un organisme notifié pour les essais, de sorte que la vérification de leur certification CE devrait généralement être aussi simple que de consulter la base de données NANDO pour le « Règlement (UE) 2016/425 Équipements de protection individuelle » et de trouver l’ON correct utilisé pour les produits en question :
DocShipper Tip
Astuce DocShipper : il n’y a que 32 organismes pour les équipements de protection des systèmes respiratoires et aucun n’est en Asie, ils sont tous localisés en Europe et en Turquie.
FAQ - Importation de masques chirurgicaux dans l'UE
Lire Plus
Ces articles pourraient vous intéresser
Info DocShipper : Vous avez aimé cet article ? Vous aimerez probablement les suivants :
- Fournisseurs chinois – Personnalisation produits et grossistes [Guide Complet]
- 13 Conseils pour réussir ses négociations avec une usine chinoise
- Comment les Chinois expédient leurs marchandises gratuitement ?
- Du fournisseur chinois aux entrepôts Amazon FBA – Comment importer et vendre des produits Made in China ?
Besoin d'aide pour la logistique ou l'approvisionnement ?
Tout d'abord, nous sélectionnons les produits adéquats auprès des fournisseurs appropriés, au prix optimal, en gérant le processus d'approvisionnement de A à Z. Ensuite, nous simplifions votre expérience d'expédition – de la collecte à la livraison finale – en vous garantissant que chaque produit, où qu'il soit, est livré à des tarifs très compétitifs.
Chat en ligne
Obtenez une assistance instantanée de notre équipe — il vous suffit de cliquer et de commencer à discuter !
Discuter
Remplir le formulaire
Remplissez notre formulaire de contact pour demander un devis, et nous vous répondrons dans les plus brefs délais.
Nous contacterNous appeler
Contactez-nous sur WhatsApp pour une assistance rapide, conviviale et personnalisée.
Nous Appeler